Каква е кислородната валентност в съединенията?
За да се определят възможните стойностивалентността на кислорода, ние трябва да изучим позицията на елемента в периодичната таблица, основните характеристики на структурата на неговия атом. Такъв подход е удобен при изучаването на въпроса коя кислородна валентност е типична и която не е характерна за нея. В най-често срещаните съединения обичайната валенция е II. Тази характеристика дава възможност да се определи броят на връзките на друг атом в крайните двоични формули, включващи кислород.
Каква е валидността на кислорода?
В началния етап на натрупване на знания засвойствата и структурата на веществата, химиците смятат, че валентността е способността да се свързва определен брой атоми с молекулата на материята. Много учени, след откриването на елемента, се опитаха да разберат кой кислород е валентност. Отговорът е получен експериментално: кислородът добавя два атома моновалентен водород към химичната реакция, което означава, че той е бивалентен. Представенията на химическата връзка се променят като знания за структурата на натрупаната материя. В тяхната теория на валентността, Дж. Люис и В. Косел разкриват същността на химическото взаимодействие от гледна точка на електронната структура. Изследователите обясняват способността на даден атом да формира определен брой връзки, като се стреми към най-стабилното енергийно състояние. Ако се постигне, най-малката частица на веществото става по-стабилна. В теорията и структурите на Луис се обръща голямо внимание на ролята на външните електрони, участващи в създаването на химическа връзка.
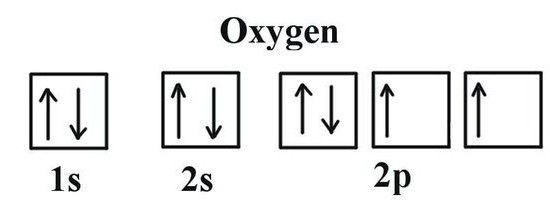
Характеристики на разположението на кислорода в периодичната таблица
За да се определи коя валентност yкислород, е необходимо да се обмислят някои характеристики на неговата електронна структура. Кислородът води 16-та група на периодичната таблица. Тривиалното наименование на семейството елементи е "халкогогени", те се отнасят към групата VI (А) по остарялата класификация. В периодичната таблица кислородът е в клетката под номер 8. Ядрото съдържа 8 положителни и толкова неутрални елементарни частици. В пространството на един атом има две нива на енергия, които възникват, когато се движат 8 електрона, от които 6 са външни.

Каква е връзката между състава на атома и валентността?
Последното ниво на кислородния атом съдържа 2неподвоени електрони. Елементът е по-нисък от флуор от гледна точка на електронегретивността (способността да привлича свързващите електронни двойки към себе си). При образуването на съединения с други елементи, кислородът привлича към себе си пълната електронна плътност, която е възникнала в молекулата (с изключение на флуоровите електрони). Постигането на стабилно състояние на външната обвивка е възможно с добавянето на две отрицателни заряди. Това означава, че кислородът изисква 2 електрона. Възможните варианти са следните: вземете един електронен (валентност II), изберете 2 електрона от друг атом (валентност II), не вземайте електрони от други атоми (валентност 0). Типичното поведение на кислорода се характеризира с втория случай. По този начин можете да използвате, за да разберете кой кислород е най-типичен в неговите обичайни съединения. Те включват повечето от оксидите на металите и неметалните елементи.

Как се проявява валентността в съединенията?
Кислородът може директновзаимодействат с много химически елементи. Известни са неговите съединения с почти всички представители на периодичната маса (с изключение на инертни газове: аргон, хелий, неон). В реакция с халогени, благородни метали, кислородът не може да влезе директно, а Ау оксиди2О3, F2О, С12О7 и други съществуват (получават се непряко). За бинарни съединения, при които се образува кислород, ковалентната връзка и полярността са характерни. Валенция в такива молекули зависи от броя на появяващите се двойки електрони, към които се привличат ядрата от различни атоми. В по-голямата част от съединенията, кислородни атоми участват в създаването на две ковалентни връзки. Например, в CO оксиди2, P2ох5, SO2, SO3, К.2О, В2ох3, Mo2ох5 и в други молекули. В хидрионния катион Н3О + кислород показва нетипична валентност III. Наличието на пероксо-групата -О-О- се дължи на необичайния характер на водородния пероксид Н.2ох2, В това съединение, кислородът проявява своята присъща валенция II.
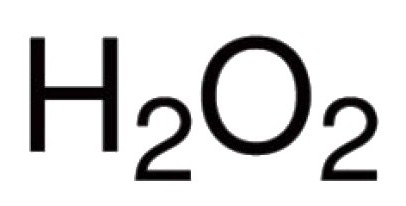
Как да се определи валентността на елементите?
Идеята за възможностите за валентност на кислородадава структурата на Луис - химическия знак на елемента, около който електроните маркират външния слой. Те участват в създаването на молекули, са част от общите електронни двойки. Формулата на Lewis ясно демонстрира валентността на кислорода, съответстваща на броя на нейните недвоени електрони (2). Същият резултат се постига чрез използването на графични електронни структури. В две клетки на външното енергийно ниво на кислорода се намират недвоените електрони (означени със стрелки във формулата). Информацията за валентността на кислорода дава възможност да се определи стойността на съседните атоми от крайната формула на бинарното съединение. За тази цел се извършват прости изчисления. На първо място, броят на о-атомите се умножава от експонента на обичайния валентен кислород. Получената стойност трябва да бъде разделена на индекса, който е посочен във формулата до химическия символ на друг елемент във връзка с кислорода. Използвайки прост метод, ние изчисляваме валентността на въглерода и фосфора в техните оксиди.
- Умножаваме индекса вдясно под знака на О в CO-диоксида2 към типичната валентност на елемента: 2 • 2 = 4. Полученото число се разделя на индекса, посочен за въглерод: 4/1 = 4. В диоксид CO2 въглеродът е в най-висшето си валентно състояние IV.
- Индексът в долната дясна част на химическия символ на кислорода във фосфорния оксид P2ох5 умножаваме по типичната валентност на атома О: 5 • 2 = 10. Разделяме това число с индекса отдясно във формулата по-долу от атома на фосфора: 10/2 = 5. В оксида фосфорът е в по-високо състояние на валентност V.