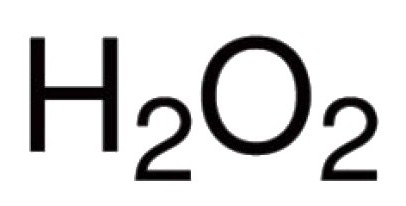Каква е степента на окисление на кислорода? Валенция и степен на окисление на кислорода
Ние всички дишаме въздух, който основно се състои отот молекулите на азота и кислорода с незначително добавяне на други елементи. По този начин, кислородът е един от най-важните химически елементи. В допълнение, молекулите му съществуват в огромен брой химически съединения, използвани в ежедневието. За да опише всички свойства на този елемент не е достатъчно и сто страници, така че ние да ограничи основните факти, истории, както и основните елементи характеристики - Валенсия и на степента на окисление на кислород, делът на прилагане на основните физични свойства.
Историята на откриването на химически елемент
Официалната дата на откриване на химическия елемент"Кислород" е 1 август 1774 година. На този ден британският химик Дж. Пристли приключи експеримента си за разграждането на живачен оксид в херметически затворен съд. В края на експеримента ученият получава газ, който поддържа изгарянето. Това откритие обаче остава незабелязано дори от самия учен. Г-н Прийстли смяташе, че е успял да различи не нов елемент, а неразделна част от въздуха. Със своите резултати Джоузеф Пристли споделя с известния френски учен и химик Антоан Лавоазие, който може да разбере какво не може да направи англичанинът. През 1775 г. Лавоазие успява да установи, че получената "съставна част на въздуха" всъщност е независим химически елемент и го нарича кислород, което на гръцки означава "образуваща киселина". Лавоазие тогава вярва, че кислородът е във всички киселини. Впоследствие бяха формулирани формули за киселини, които не съдържат кислородни атоми, но името беше прието.
Кислород - характеристики на структурата на молекулата
Този химичен елемент е безцветен газ, който не мирише и не вкусва. Химическа формула - За2, Химиците се отнасят до конвенционалния диатомен кислород като "атмосферен кислород" или "диоксиген".

Валенция и степен на окисление на кислорода
Под валентността на даден химичен елемент имаспособността да се прикрепят към себе си определен брой атоми на друг химичен елемент. Валентността на един кислороден атом е две. Валентността на кислородна молекула също е равна на две, тъй като два атома са свързани помежду си и имат способността да прикрепят към структурата си още един атом от друго съединение, т.е. да образуват ковалентна връзка с него. Например водната молекула Н2О се получава като резултат от образуването на ковалентна връзка между един кислороден атом и два водородни атома.
Кислородът се съдържа в много от познатитехимични съединения. Има дори отделен тип химически съединения - оксиди. Това са вещества, получени чрез комбиниране на почти всеки химичен елемент с кислород. Степента на окисление на кислорода в оксидите е -2. При някои съединения обаче този показател може да е различен. Това ще бъде описано по-подробно по-долу.
Физични свойства на кислорода
Нормалният диатомен кислород е газ, който няма цвят, мирис и вкус. В нормално състояние плътността му е 1.42897 кг / м3, Теглото на един литър вещество е малко по-малко от 1,5 грама, т.е. в чиста форма кислородът е по-тежък от въздуха. Когато се нагрява, молекулата се дисоциира в атоми.

Когато температурата на средата спадне до -189.2 заС кислорода променя структурата си от газообразно до течно. В същото време се появява кипене. С намаление на температурата до -218.35 заC има промяна в структурата от течност до кристална. При тази температура, кислородът има формата на синкави кристали.
При стайна температура, кислород е умерено разтворим във вода - по едната му литър 31 милилитър на кислород. Разтворимост с други вещества: 220 ml на 1 литър етанол, 231 ml на 1 литър ацетон.
Химични свойства на кислорода
Химическите свойства на кислорода могат да бъдат написаниЦелият Талмуд. Най-важното свойство на кислорода е окисляването. Това вещество е много силен оксидант. Кислородът може да взаимодейства с почти всички известни елементи от периодичната таблица. В резултат на това взаимодействие се образуват оксиди, както бе обсъдено по-рано. Степента на окисление на кислорода в съединенията с други елементи е основно -2. Пример за такива съединения е водата (Н.2О), въглероден диоксид (CO2), калциев оксид, литиев оксид и др. Но има определена категория оксиди, наречени пероксиди или пероксиди. Тяхната особеност е, че в тези съединения има пероксидна група "-О-О-". Тази група намалява оксидационните свойства на О2, така че степента на окисление на кислорода в пероксида е -1.
В комбинация с активните алкални метали, кислородът образува супероксиди или суперексиди. Пример за такива формации е:
- калиев супероксид (KO2);
- Рубидиев супероксид (RbO2).
Тяхната особеност е, че степента на окисление на кислорода в супероксидите е -1/2.
В комбинация с най-активния химичен елемент - флуор, се получават флуориди. Те ще бъдат описани по-долу.
Най-висока степен на окисление на кислорода в съединенията
В зависимост от веществото, с което кислородът взаимодейства, има седем степени на окисление на кислорода:
- -2 в оксиди и органични съединения.
- -1 в пероксидите.
- -1/2 в супероксид.
- -1/3 - в неорганични озониди (валидни за триатомен кислород - озон).
- +1/2 в солите на кислородния катион.
- +1 в кислороден монофлуорид.
- +2 - в кислород дифлуорид.
Както виждаме, най-висока степен на окисление на кислородасе постига в оксиди и органични съединения, а в флуоридите има дори положителна степен. Не всички видове взаимодействия могат да се извършват естествено. Някои съединения изискват специални условия, например: високо налягане, висока температура, излагане на редки съединения, които почти не се срещат в природата. Да разгледаме основните връзки на кислорода с други химически елементи: оксиди, пероксиди и флуориди.
Класификация на оксидите по киселинно-базични свойства
Има четири типа оксиди:
- основният;
- киселина;
- неутрална;
- амфотерни.
Степента на окисление на кислорода в съединенията от тези видове е -2.
- Основните оксиди са съединения с метали, които имат ниска степен на окисление. Обикновено при взаимодействие с киселини се получава съответната сол и вода.
- Киселинни окиси - окиси от неметали с висока степен на окисление. Когато се добавя вода към тях, се образува киселина.
- Неутралните оксиди са съединения, които не влизат в реакция с киселини или бази.
- Амфотерните оксиди са съединения с метали, които имат ниска електронегодност. Те, в зависимост от обстоятелствата, проявяват свойствата както на киселинни, така и на основни оксиди.
Пероксидите, степента на окисление на кислорода в водороден прекис и други съединения
Пероксидите са кислородните съединения салкални метали. Те се получават чрез изгарянето на тези метали в кислород. Пероксидите на органичните съединения са изключително експлозивни. Те могат да бъдат получени и чрез абсорбция с кислородни оксиди. Примери за пероксиди:
- водороден пероксид (Н.2О2);
- бариев пероксид (BaO2);
- натриев пероксид (Na2О2).
Всички те са обединени от факта, че те съдържат кислородната група -О-О-. В резултат кислородното окисление в пероксидите е -1.

Други видове пероксиди са:
- суперексиди (супероксиди, в които кислородът има оксидация -1/2);
- неорганични озониди (силно нестабилни съединения, които имат структура на озонния анион);
- Органични озониди (съединения, имащи в структурата си -О-0-О-връзка).
Флуориди, степента на окисление на кислорода в OF2
Флуоридът е най-активният елемент от всичкиизвестни. Следователно, взаимодействието на кислорода с флуор не произвежда оксиди, а флуориди. Те се наричат така, защото в това съединение не е кислород, но флуорът е окислител. Флуоридите не могат да се получат естествено. Те се синтезират само, като се получава чрез свързване на флуор с воден разтвор на КОН. Кислородните флуориди се разделят на:
- кислороден дифлуорид (OF2);
- Кислороден монофлуорид (О2F2).
Нека разгледаме по-подробно всяка от връзките. Кислородният дифлуорид е безцветен газ с изразен неприятен мирис. При охлаждане той кондензира в жълтеникава течност. В течно състояние, тя се смесва лошо с вода, но е добре с въздух, флуор и озон. Според неговите химични свойства, кислородният дифлуорид е много силен окислител. Степента на окисление на кислорода в OF2 е +1, т.е. в това съединение флуорът е окислител и кислородът е редуциращ агент. НА2 То е много токсично, като токсичност надвишавачист флуор и подходи към фосген. Основното използване на това съединение е като окислител за ракетно гориво, тъй като кислородният дифлуорид не е експлозивен.
Кислороден монофлуорид в нормално състояниее жълтеникаво твърдо вещество. При топене тя образува червена течност. Той е мощен окислител, той е изключително експлозивен при взаимодействие с органични съединения. В това съединение кислородът проявява окислителни състояния от +2, т.е. в това флуорно съединение, кислородът действа като редуциращ агент и флуор като окислител.
Озон и неговите съединения
Озонът е молекула, която има три кислородни атома,свързани помежду си. В нормално състояние е синият газ. Когато се охлади, тя образува тъмносиня течност, близка до индиго. В твърдо състояние са кристали с тъмносин цвят. Озонът има остър мирис, в природата може да се усети във въздуха след тежка гръмотевична буря.
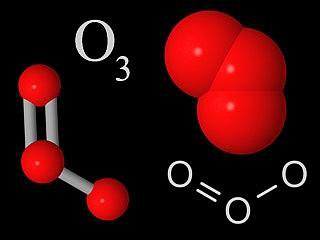
Озонът, като обикновения кислород, е многосилен оксидант. Чрез химическите свойства се доближава до силни киселини. Когато се излага на окиси, озонът повишава своето окислително състояние с освобождаване на кислород. Но в същото време степента на окисление на кислорода намалява. В озона химическите връзки не са толкова силни, колкото в О2, следователно при нормални условия без приложенитетя може да се разпадне в кислород с освобождаването на топлинна енергия. Когато температурата на ефекта върху озоновата молекула се увеличи и когато налягането намалее, процесът на разлагане в диатомен кислород с освобождаване на топлина се ускорява. В този случай, ако има голямо съдържание на озон в космоса, този процес може да бъде придружен от експлозия.
Тъй като озонът е много силен окислител и практически всички процеси с участието му произвеждат голямо количество О2, тогава озонът е изключително токсично вещество. Въпреки това, в горните слоеве на атмосферата озоновият слой играе ролята на отражател от ултравиолетовото излъчване на слънчевите лъчи.
От озона, използвайки лабораторни инструментисъздават органични и неорганични озониди. Това е много нестабилно в структурата на материята, така че тяхното създаване в естествени условия е невъзможно. Озонидите се съхраняват само при ниски температури, тъй като при нормални температури те са изключително експлозивни и токсични.
Използването на кислород и неговите съединения в промишлеността
Поради факта, че по едно време учените са научили,Каква степен на оксидация в кислорода, когато взаимодейства с други елементи, той и неговите съединения са широко използвани в индустрията. Особено след като турборазширителите бяха изобретени в средата на ХХ век - агрегати, способни да превърнат потенциалната енергия на кислорода в механична.

В химическата промишленост се използва кислородкато окислител на въглеводороди в съдържащи киселини съединения, като алкохоли, киселини и др. В медицината се използва при понижено налягане за лечение на пациенти с белодробни проблеми, за да се запази жизнената активност на организма. В селското стопанство се използват малки дози чист кислород за развъждане на риба в езера, за увеличаване на дела на говеда и др.
Кислородът е мощен окислител, без който не е възможно да съществува
Над много неща е написано какъв вид кислородима окислителни състояния при реагиране с различни съединения и елементи, какви видове кислородни съединения съществуват, кои видове са животозастрашаващи и кои не. Човек може да остане неразбираем - как, поради цялата си токсичност и високото ниво на окисляване, кислородът е един от елементите, без който животът на Земята е невъзможен? Факт е, че нашата планета е много балансиран организъм, адаптиран специално към тези вещества, които се съдържат в атмосферния слой. Той участва в цикъла, който изглежда така: човек и всички други животни консумират кислород и произвеждат въглероден диоксид, а растенията в по-голямата си част консумират въглероден диоксид и произвеждат кислород. Всичко в света е взаимосвързано и загубата на една връзка в тази верига може да доведе до разрушаване на цялата верига. Не трябва да забравяме това и да се грижим изцяло за живота на планетата, а не само за нейните индивидуални представители.
</ p>