Молекулярна и структурна формула на фенола
Фенолите са общоприетото наименование за ароматни алкохоли. По свойствата си веществата са слаби киселини. От голямо практическо значение са много хомолози на хидроксибензен С6Н50H (формула на фенола) - най-простият представител на класа. Нека разгледаме по-подробно това.
Феноли. Обща формула и класификация
Общата формула на органичните вещества, свързани сароматни алкохоли, - R-OH. Молекулите на фенолите и крезолите са формирани от радикала - фенил С6Н5, с който една или няколко хидроксилни групи ОН (хидрокси групи) са директно свързани. Чрез техния брой в молекулата, фенолите се класифицират в единични, двойни и полиатомични. Монотомни съединения от този тип са фенол и крезол. Най-често срещаните полихидроксибензоли са нафтолите, които съдържат в състава си 2 кондензирани ядра.

Фенолът е представител на ароматни алкохоли
Фенолът вече е бил известен на текстилните работници още през XVIII век: тъкачите го използват като боя. При дестилацията на каменовъгления катран през 1834 германският химик Ф. Рюд отличава кристалите на това вещество с характерна сладка миризма. Латинското наименование на въглищата е въглерод, така че съединението е наречено карбол (киселинна киселина). Германският изследовател не успя да определи състава на веществото. Молекулярната формула на фенола е създадена през 1842 г. от О. Лоран, който разглежда въглеводородното производно на бензола. За новата използвана киселина името "фенил". Чарлз Жерар определи, че веществото е алкохол и го нарече фенол. Първоначалните области на приложение на съединението са медицината, тентата на кожата, производството на синтетични багрила. Характеристики на веществото:
- Рационална химична формула -6Н5ОН.
- Молекулното тегло на съединението е 94.11 а. например m.
- Брутната формула, отразяваща състава, е C6Н6О.

Електронна и пространствена структура на фенолната молекула
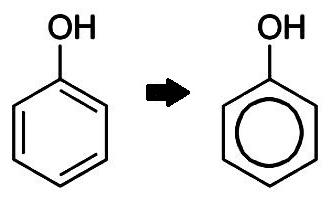
Предлага се цикличната структурна формула на бензолаГерманският органичен химик Ф. Кекуле през 1865 г., а малко преди него - И. Лошмит. Учените представляват молекула на органичната материя под формата на обикновен шестоъгълник с променливи прости и двойни връзки. Според съвременните идеи, ароматното ядро е специален вид пръстенна структура, наречена "конюгирана връзка".
Шест въглеродни атома С преминават през процес sp2- хибридизация на електронни орбитали. П-електронните облаци, които не участват в образуването на С-С връзки, се припокриват над и под равнината на ядрото на молекулата. Има две части от общия електронен облак, който покрива целия пръстен. Структурната формула на фенола може да изглежда различно, като се има предвид историческият подход към описанието на структурата на бензола. За да се подчертае ненаситената природа на ароматните въглеводороди, три от шестте връзки обикновено се считат за двойни, които са разпръснати с три прости.
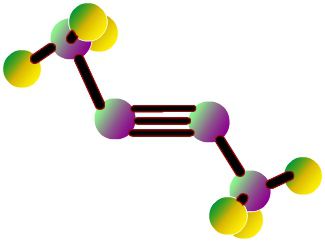
Поляризация на връзката в хидроксилната група
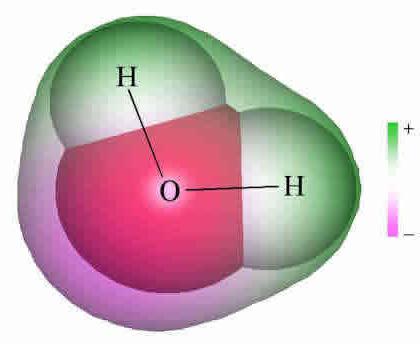
В най - простия ароматен въглеводород - бензен С6Н6 - електронният облак е симетричен. Фенолната формула се различава с една хидроксилна група. Наличието на хидроксил нарушава симетрията, което се отразява в свойствата на веществото. Връзката между кислород и водород в хидроксилната група е полярна ковалентна. Изместването на общата двойка електрони към кислородния атом води до появата на отрицателен заряд (частичен заряд) върху него. Водородът е лишен от електрони и получава частичен заряд на "+". В допълнение, кислородът в групата O-H е собственик на две двойки електронни връзки, които не са споделени. Един от тях е привлечен от електронния облак от ароматно ядро. По тази причина връзката става по-поляризирана, а водородният атом е по-лесно заменен от метали. Моделите дават представа за асиметричния характер на фенолната молекула.

Особености на взаимодействието на атомите във фенола
Един електронен облак от ароматното ядро вмолекулата на фенола реагира с хидроксилната група. Има явление, наречено конюгиране, в резултат на което природната двойка електрони на кислородния атом на хидроксилната група е привлечена от бензеновия цикъл. Намаляването на отрицателния заряд се компенсира от още по-голяма поляризация на връзката в групата О-Н.
Ароматното ядро също променя систематаелектронно разпространение. Той се намалява с въглерода, който е свързан с кислород, и се увеличава в близкото тях атоми в орто позиция (2 и 6). Конюгирането води до натрупването на заряд на "-" върху тях. Освен това "смяна плътност - движението си от атомите в мета-позиция (3 и 5) към въглерод в пара положение (4). Фенолната формула за улесняване на изучаването на конюгирането и взаимното влияние обикновено съдържа номерацията на атомите в бензеновия пръстен.

Обяснение на химичните свойства на фенола въз основа на неговата електронна структура
Процесите на конюгиране на ароматното ядро ихидроксил засягат свойствата на двете частици и на цялото вещество. Например, високата електронна плътност на атомите в орто- и пара позициите (2, 4, 6) прави C-H връзките на ароматния пръстен на фенола по-реактивен. Отрицателният заряд на въглеродните атоми в мета позиции намалява (3 и 5). Атака на електрофилни частици в химични реакции, подложени на въглерод, разположени в орто- и пара-позиции. При реакцията на броене на бензола, промените настъпват при силно нагряване и наличие на катализатор. Получава се монохалогенно производно - бромобензен. Фенолната формула позволява веществото да реагира с бром почти моментално без нагряване на сместа.
Ароматната сърцевина влияе върху полярността на връзката вхидрокси група, увеличавайки я. Водородният атом става по-мобилен в сравнение с ограничаващите алкохоли. Фенолът реагира с алкали, образувайки фенолни соли. Етанолът не взаимодейства с алкали или по-скоро реакционните продукти - етанолатите - се разлагат. По химичен път фенолите са по-силни киселини от алкохолите.
Представители на класа на ароматните алкохоли
Горната формула на хомолога на фенол-крезол (метилфенол, хидрокситолуен) -С7Н8О. Веществото в природните суровини често придружава фенол, също има антисептични свойства. Други фенолови хомолози:
- Пирокатехин (1,2-хидроксибензен). Химична формула - C6Н4(ОН)2.
- Резорцинол (1,3-хидроксибензен) -С6Н4(ОН)2.
- Пирогалол (1,2,3-трихидроксибензен) -С6Н3(ОН)3.
- Нафтол. Грубата формула на веществото е C10Н7ОН. Използва се в производството на бои, лекарства, ароматни съединения.
- Тимол (2-изопропил-5-метилфенол). Химична формула - C6Н3СН3(ОН) (С3Н7). Използва се в химия на органичния синтез, медицина.
- Ванилин, в допълнение към фенолния радикал, съдържа етерна естерна група и алдехиден остатък. Глобалната формула за съединението е C8Н8О3, Ванилин се използва широко като изкуствен аромат.
Формула на реагента за разпознаване на феноли
Качественото определяне на фенола може да се извърши скато се използва бром. В резултат на реакцията на заместване се утаява бяла утайка от трибромфенол. Пирокатехин (1,2-хидроксибензен) е оцветен в зелено в присъствието на разтворен железен хлорид. Със същия реагент фенолът реагира химически и се образува трифенолат, който има пурпурен цвят. Качествена реакция към резорцин е появата на тъмно виолетово оцветяване в присъствието на железен хлорид. Постепенно цветът на разтвора става черен. Реагентната формула, която служи за разпознаване на фенола и някои от неговите хомолози, е FeCl3 (железен хлорид).

Хидроксибензен, нафтол, тимол са всички феноли. Общата формула и съставът на веществата дава възможност да се определи дали тези съединения принадлежат към ароматните серии. Всички органични вещества, съдържащи във формулата си фенилов радикал С6Н5, с които хидрокси групите са директно свързани,имат специални свойства. Те се различават от алкохолите с по-добре изразена киселинност. В сравнение с веществата от хомоложната серия бензол, фенолите са по-активни химични съединения.
</ p>